مراجعة مصغرة
المخفر ضد السرطان: علامات السرطان العالمية فقط
تشنغشن تشيان 1، شياو لونغ زو 2، وي لي 1، 3، يين شان لي 4، وين تشيانغ يو 5
1Shanghai Epiprobe Biotechnology Co., Ltd، شنغهاي 200233، الصين؛2 قسم الجراحة العامة، المستشفى الأول التابع لجامعة هاربين الطبية، هاربين 150001، الصين؛3Shandong Epiprobe Medical Laboratory Co., Ltd، هيزي 274108، الصين؛4 مستشفى الشعب في منطقة نينغشيا ذاتية الحكم لقومية هوي، جامعة نينغشيا الطبية، ينشوان 750002، الصين؛5مركز شنغهاي للصحة العامة السريري وقسم الجراحة العامة، مستشفى هواشان ومعهد نقائل السرطان ومختبر علم الوراثة الحمض النووي الريبي، معاهد العلوم الطبية الحيوية، كلية شنغهاي الطبية، جامعة فودان، شنغهاي 200032، الصين
خلاصة
السرطان هو السبب الرئيسي للوفاة في جميع أنحاء العالم.الكشف المبكر عن السرطان يمكن أن يقلل من معدل الوفيات بجميع أنواع السرطان؛ومع ذلك، لا توجد مؤشرات حيوية فعالة للكشف المبكر عن معظم أنواع السرطان.لقد كانت مثيلة الحمض النووي دائمًا هدفًا رئيسيًا للاهتمام لأن مثيلة الحمض النووي تحدث عادةً قبل التغيرات الجينية الأخرى التي يمكن اكتشافها.أثناء التحقيق في السمات الشائعة للسرطان باستخدام تسلسل تحديد المواقع الدليلي الجديد لمثيلة الحمض النووي، ظهرت سلسلة من علامات السرطان العالمية فقط (UCOMs) كمرشحين أقوياء للكشف المبكر الفعال والدقيق عن السرطان.في حين أن القيمة السريرية للمؤشرات الحيوية للسرطان الحالية تتضاءل بسبب الحساسية المنخفضة و/أو النوعية المنخفضة، فإن الخصائص الفريدة لـ UCOMs تضمن نتائج ذات معنى سريريًا.التحقق من صحة الإمكانات السريرية لـ UCOMs في سرطانات الرئة وعنق الرحم وبطانة الرحم والظهارة البولية يدعم أيضًا تطبيق UCOMs في أنواع السرطان المتعددة والسيناريوهات السريرية المختلفة.في الواقع، تخضع تطبيقات UCOMs حاليًا للتحقيق النشط مع مزيد من التقييم في الكشف المبكر عن السرطان، والتشخيص المساعد، وفعالية العلاج، ومراقبة تكرار المرض.تعد الآليات الجزيئية التي تكتشف بها UCOM السرطانات هي الموضوعات المهمة التالية التي يجب دراستها.يتطلب تطبيق UCOMs في سيناريوهات العالم الحقيقي أيضًا التنفيذ والتحسين.
الكلمات الدالة
الكشف عن السرطان.فحص السرطان؛مثيلة الحمض النووي.علم الوراثة السرطانية.المؤشرات الحيوية للسرطان
لماذا نحن بحاجة ماسة إلى الجديد المؤشرات الحيوية؟
بعد مكافحة السرطان لأكثر من قرن من الزمان، لا يزال السرطان يمثل التهديد البيولوجي الأكثر فتكا للبشرية.لا يزال السرطان مصدر قلق صحي عالمي، حيث يقدر عدد حالات السرطان الجديدة بنحو 19.3 مليون حالة جديدة وما يقرب من 10 ملايين حالة وفاة في عام 20201. وفي عام 2020، تم تشخيص ما يقدر بنحو 4.6 مليون حالة جديدة من السرطان في الصين، وهو ما يمثل 23.7٪ من حالات السرطان الجديدة على مستوى العالم وفقًا لـ GLOBOCAN1.علاوة على ذلك، نُسبت حوالي 3 ملايين حالة وفاة إلى السرطان في الصين في عام 2020، وهو ما يمثل 30% من الوفيات المرتبطة بالسرطان على مستوى العالم.وتشير هذه الإحصائيات إلى أن الصين تحتل المرتبة الأولى في معدل الإصابة بالسرطان والوفيات به.علاوة على ذلك، يبلغ معدل البقاء على قيد الحياة من السرطان لمدة 5 سنوات 40.5%، وهو أقل بمقدار 1.5 مرة من معدل البقاء على قيد الحياة لمدة 5 سنوات في الولايات المتحدة.إن انخفاض معدلات البقاء على قيد الحياة وارتفاع معدلات الوفيات في الصين مقارنة بالدول ذات مؤشرات التنمية البشرية الأعلى يشير إلى أن هناك حاجة ماسة إلى نظام فعال وفعال من حيث التكلفة للوقاية من السرطان ومراقبته.يعد الكشف المبكر عن السرطان أحد أهم العناصر في نظام الرعاية الصحية.يمكن أن يؤدي الاكتشاف المبكر للسرطان إلى تحسين التشخيص والبقاء على قيد الحياة في مرحلة مبكرة في جميع أنواع السرطان تقريبًا.أدت استراتيجيات الفحص الناجحة إلى انخفاض كبير في معدلات الإصابة بسرطانات عنق الرحم والثدي والقولون والمستقيم والبروستاتا.
ومع ذلك، فإن تحقيق الكشف المبكر عن السرطان ليس بالمهمة السهلة.إن التحقيق في بيولوجيا السرطان المبكر والتشخيص، وتحديد العلامات الحيوية الموثوقة للكشف المبكر والتحقق من صحتها، وتطوير تقنيات الكشف المبكر الدقيقة التي يسهل الوصول إليها، كانت دائمًا أكبر العقبات في هذه العملية.يمكن للكشف الدقيق عن السرطان أن يميز بين الآفات الحميدة والخبيثة، مما يساعد على تجنب الإجراءات غير الضرورية ويسهل المزيد من إدارة المرض.وتشمل استراتيجيات الكشف المبكر الحالية الخزعات المعتمدة على المنظار، والتصوير الطبي، وعلم الخلايا، والمقايسات المناعية، واختبارات العلامات الحيوية.نظرًا لكونها تدخلية ومكلفة، فإن الخزعات المعتمدة على المنظار تحمل عبئًا ثقيلًا بطبيعتها كإجراء طبي كبير يعتمد على موظفين محترفين.وكما هو الحال مع علم الخلايا، تعتمد طريقتا الفحص على المتخصصين في المجال الطبي، وتعتمدان على الحكم الشخصي بأداء بعيد عن المثالية8.في المقابل، تعتبر المقايسات المناعية غير دقيقة إلى حد كبير، نظرًا لارتفاع معدلات النتائج الإيجابية الكاذبة.يتطلب التصوير الطبي، كأسلوب فحص، معدات باهظة الثمن وفنيين متخصصين.ومن ثم، فإن التصوير الطبي محدود للغاية بسبب انخفاض إمكانية الوصول إليه.لكل هذه الأسباب، يبدو أن المؤشرات الحيوية هي الخيار الأفضل للكشف المبكر عن السرطان.
المراسلات مع: يينشان لي ووينكيانغ يو
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
معرف أوركيد: https://orcid.org/0009-0005-3340-6802 و
https://orcid.org/0000-0001-9920-1133
تم الاستلام في 22 أغسطس 2023؛تم قبوله في 12 أكتوبر 2023؛
نُشر على الإنترنت في 28 نوفمبر 2023.
متاح على www.cancerbiomed.org
©2023 بيولوجيا وطب السرطان.المشاع الإبداعي
الإسناد-غير تجاري 4.0 الرخصة الدولية
يتم تصنيف المؤشرات الحيوية حاليًا على أنها بروتينات، أو علامات طفرة الحمض النووي، أو علامات لاجينية، أو شذوذات صبغية، أو علامات RNA مشتقة مباشرة من الأورام، أو شظايا الورم التي تم الحصول عليها بشكل غير مباشر من سوائل الجسم.علامات البروتين هي المؤشرات الحيوية الأكثر تطبيقًا على نطاق واسع في فحص السرطان وتشخيصه.المؤشرات الحيوية للبروتين، كمؤشرات حيوية للفحص، محدودة بسبب الميل إلى التأثر بالآفات الحميدة، مما يؤدي إلى الإفراط في التشخيص والعلاج الزائد، كما تم الإبلاغ عن البروتين الجنيني ألفا ومستضد البروستاتا النوعي (PSA) 9،10.تشتمل علامات RNA على أنماط التعبير الجيني وعلامات RNA الأخرى غير المشفرة. يمكن اكتشاف مجموعة من علامات RNA للتعبير الجيني باستخدام عينات البول، والتي كانت حساسيتها بعيدة عن أن تكون مرضية (60٪) للأورام الأولية، ويمكن اكتشافها تتأثر بطبيعة التحلل السهل للحمض النووي الريبي (RNA) في البيئة الطبيعية.تواجه العلامات الجينية واللاجينية مشكلة انتشار الأورام ومحدودية أنواع السرطان.
لقد كان مثيل الحمض النووي مرشحًا قويًا كمؤشر حيوي للكشف المبكر منذ أن تم ربطه لأول مرة بالسرطان بواسطة فاينبيرج في عام 1983. وقد لوحظت انحرافات مثيلة الحمض النووي في جميع مراحل السرطان، في وقت مبكر من المرحلة السابقة للتسرطن.عادةً ما يحدث فرط ميثيل الحمض النووي الشاذ في جزر CpG في مروجي الجينات لمواجهة مثبطات الورم .أشارت الدراسات أيضًا إلى أن فرط ميثيل الحمض النووي غير الطبيعي يشارك في تنظيم منظمات النمو.قد يؤدي وادي مثيلة الحمض النووي، والذي يرتبط عادةً بالمنظمين التنمويين والسرطانات المفرطة الميثيل، إلى تحويل وضع التعبير الجيني إلى وضع أكثر استقرارًا يعتمد على مثيلة الحمض النووي وتقليل الاتصال بهستون الميثيل H3K27me3 وبروتينات بوليكومب المرتبطة به.
من بين العدد الكبير من علامات مثيلة الحمض النووي المنشورة، ظهر العديد منها بنجاح في السوق؛ومع ذلك، فإن علامات مثيلة الحمض النووي ولوحات التشخيص الحالية التي يتم تسويقها تجاريًا لم تطلق بعد إمكانات الكشف المبكر عن السرطان بشكل كامل لأسباب متعددة.في حين تظهر في الغالب أداء مقبولا باستخدام معلومات قاعدة البيانات، فإن أداء هذه المؤشرات الحيوية عادة ما يكون أقل مثالية في العالم الحقيقي بسبب حقيقة أن عينات العالم الحقيقي غالبا ما تكون أكثر تعقيدا وليست تمثيلية مثل تلك المختارة في قواعد البيانات.تبين أن الكشف المبكر عن مثيلة السرطان المتعدد القائم على تسلسل الجيل التالي له حساسية تبلغ 16.8% و40.4% فقط في المرحلة الأولى والثانية من السرطان، على التوالي.تتطلب اختبارات الكشف المبكر ثباتًا أكبر ومؤشرات حيوية أكثر دقة.
اكتشاف علامة السرطان العالمية الوحيدة (UCOM) باستخدام تسلسل تحديد المواقع الدليلي (GPS)
على الرغم من عقود من أبحاث السرطان، لم يتم تحقيق الوقاية والعلاج المرضيين.هناك حاجة إلى منهجيات جديدة لتمكين الباحثين من إجراء تقييم شامل للسرطان.على مدى السنوات الـ 23 الماضية، تم توسيع 6 سمات مميزة للسرطان، مثل تجنب موت الخلايا المبرمج، وغزو الأنسجة والانبثاث، وما إلى ذلك، إلى 14 من خلال تضمين ميزات مثل إعادة البرمجة اللاجينية غير الطفرية والميكروبيومات متعددة الأشكال.ومع الكشف عن المزيد من التفاصيل المتعلقة بالسرطان، يتم تقديم المزيد من وجهات النظر حول أبحاث السرطان.لقد دخلت أبحاث السرطان تدريجيًا إلى عصر جديد في اتجاهين (القواسم المشتركة والفردية).مع تطور علم الأورام الدقيق في السنوات الأخيرة، أصبح تركيز أبحاث السرطان يميل نحو العلاج الفردي المستهدف وعدم تجانس السرطان.وهكذا، ركزت المؤشرات الحيوية للسرطان التي تم تحديدها مؤخرًا بشكل أساسي على أنواع محددة من السرطان، مثل سرطان عنق الرحم القسري PAX6 وBMP3 لسرطان القولون والمستقيم.يختلف أداء هذه المؤشرات الحيوية الخاصة بأنواع السرطان، ولكن لا يزال من غير الممكن للأفراد المعرضين للإصابة بجميع أنواع السرطان في وقت واحد بسبب محدودية الحصول على العينات البيولوجية والتكلفة العالية.سيكون من المثالي أن نتمكن من تحديد علامة حيوية واحدة قوية تكون فعالة لجميع أنواع السرطان في مرحلة مبكرة.
لتحقيق هذا الهدف المثالي، يجب اختيار مرشح أفضل للعلامات الحيوية من قائمة أنواع العلامات الحيوية المحتملة.من المعروف أن انحرافات مثيلة الحمض النووي، من بين جميع الملامح الجينية واللاجينية، مرتبطة بالسرطان وهي من أقدم التشوهات المرتبطة بالسرطان، إن لم تكن الأولى، التي تحدث تاريخيًا.بدأ التحقيق في مثيلة الحمض النووي في وقت مبكر، ولكن تم إعاقةه بسبب عدم وجود طرق بحث.من بين 28 مليون موقع CpG محتمل للمثيلة في الجينوم، يجب اكتشاف عدد يمكن التحكم فيه ومواءمته مع الجينوم لفهم تكوين الأورام بشكل أفضل.يمكن لتسلسل ثنائي كبريتيت الجينوم الكامل (WGBS)، والذي يعتبر المعيار الذهبي لتسلسل مثيلة الحمض النووي، أن يغطي فقط 50٪ من Cs في الخلايا السرطانية بسبب طبيعة علاج ثنائي كبريتيت الذي يكسر شظايا الحمض النووي ويقلل من تعقيد الجينوم خلال تحويل Cs إلى Ts25.الطرق الأخرى، مثل رقائق 450 ألف، تغطي فقط 1.6% من مثيلة الجينوم.استنادًا إلى بيانات 450 ألفًا، تتمتع لوحة الكشف عن مثيلة الحمض النووي بحساسية 35.4% لستة أنواع من سرطانات المرحلة الأولى.أصبحت القيود المفروضة على أنواع السرطان، وضعف الأداء، والضوضاء الناتجة عن طرق الكشف في العملية التحليلية أكبر العقبات أمام لوحات الكشف عن السرطان.
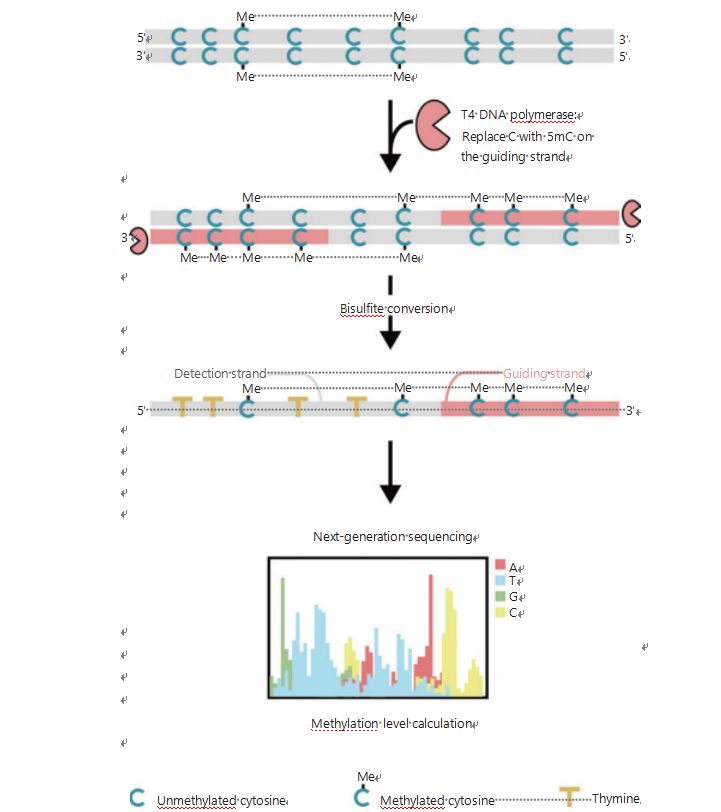
للتحقيق بشكل أفضل في الأنماط اللاجينية للخلايا أثناء تكوين الأورام والورم النقيلي، قمنا بتطوير نظام تحديد المواقع العالمي (GPS) الفريد للكشف عن مثيلة الحمض النووي على مستوى الجينوم، والذي يغطي ما يصل إلى 96٪ من مواقع CpG في 0.4 مليار قراءة.نظام تحديد المواقع العالمي (GPS) عبارة عن طريقة تسلسل ثنائية تستخدم نهاية 3 of لجزء الحمض النووي من السيتوزينات الميثيل غير القابلة للتحويل بعد معالجة بيكبريتيت والتي توجه محاذاة حساب مثيلة الحمض النووي للنهاية 5 of من خلال تسلسل نهاية الزوج (الشكل 1) .يساعد شريط توجيه ميثيل-سيتوزين، الذي يعمل كشريط قالب، في محاذاة منطقة GC العالية التي تستعيد بيانات التسلسل الأكثر إهمالًا في WGBS التقليدية.توفر ميزة التغطية العالية لنظام تحديد المواقع (GPS) كمية هائلة من معلومات مثيلة الحمض النووي، مما يسمح لنا بفحص ملفات مثيلة السرطان بدقة أعلى بكثير في المناطق التي لم يتم التحقيق فيها سابقًا.
يوفر لنا نظام تحديد المواقع العالمي (GPS) أداة قوية لدراسة تجانس السرطان، والتي يمكن أن تبسط أبحاث السرطان إلى حد كبير، وربما تجد تفسيرًا عالميًا لنشوء الأورام والانتشار.أثناء تحليل بيانات نظام تحديد المواقع العالمي (GPS) لخطوط الخلايا السرطانية، تمت مواجهة ظاهرة فريدة بشكل متكرر.كان هناك عدد من المناطق التي يبدو أنها مفرطة الميثيل بشكل غير طبيعي في أنواع متعددة من عينات السرطان.تم التحقق من صحة هذه النتيجة غير المتوقعة لاحقًا لتكون بمثابة UCOMs.تم تحليل أكثر من 7000 عينة من 17 نوعًا من السرطان في قاعدة بيانات أطلس جينوم السرطان (TCGA)، ومن بينها حددنا أول UCOM، HIST1H4F، وهو جين مرتبط بالهيستون ومفرط الميثيل في جميع أنواع السرطان.تم بعد ذلك العثور على سلسلة من UCOMs والتحقق من صحتها في قاعدة بيانات TCGA، وقاعدة بيانات Gene Expression Omnibus (GEO)، والعينات السريرية الواقعية.اعتبارًا من الآن، تم العثور على HIST1H4F وPCDHGB7 وSIX6 والتحقق من صحتها باعتبارها UCOMs.يقدم الاكتشاف غير المتوقع لـ UCOMs إجابة قوية على الحاجة إلى الكشف المبكر عن السرطان.توفر UCOMs حلاً للكشف عن علامة واحدة لسرطانات متعددة.
خصائص UCOMs
عند التحقق من الصحة، تبين أن UCOMs تظهر أربع خصائص رئيسية تمكن UCOMs من تجاوز فعالية المؤشرات الحيوية الحالية (الشكل 2).
فريدة من نوعها للأورام الخبيثة
تعد UCOMs فريدة من نوعها بالنسبة للآفات السرطانية أو ما قبل السرطانية ولا تتأثر بالتغيرات الفسيولوجية الطبيعية.بعض العلامات الحالية المرتبطة بالسرطان والتي تم تطبيقها على نطاق واسع في الكشف المبكر و/أو الفحص أدت إلى الإفراط في التشخيص.يتم أيضًا اكتشاف مستويات PSA المرتفعة، وهي أداة فحص معتمدة سريريًا، في الحالات الحميدة، مثل تضخم البروستاتا والتهاب البروستاتا.يؤدي التشخيص الزائد والعلاج الزائد الناتج إلى انخفاض نوعية الحياة بسبب المضاعفات المعوية والبولية والجنسية.لم تسفر المؤشرات الحيوية الأخرى المستندة إلى البروتين والمستخدمة على نطاق واسع في البيئة السريرية، مثل CA-125، عن فوائد كبيرة أثناء تكبد الإفراط في التشخيص والعلاج الزائد.إن الخصوصية العالية لـ UCOMs للأورام الخبيثة تتجنب أوجه القصور هذه.يميز UCOM، PCDHGB7، بكفاءة الآفات الحرشفية عالية الجودة داخل الظهارة (HSILs) وسرطان عنق الرحم من العينات الطبيعية والآفات الحرشفية منخفضة الدرجة داخل الظهارة (LSILs)، في حين أن معظم العلامات الحيوية الأخرى يمكنها فقط التمييز بين سرطان عنق الرحم والعينات الطبيعية.على الرغم من أن PCDHGB7 لا يكتشف اختلافات كبيرة بين بطانة الرحم الطبيعية وتضخم بطانة الرحم، فقد تم اكتشاف اختلافات كبيرة بين بطانة الرحم الطبيعية وتضخم غير نمطي، وتم اكتشاف اختلافات أكبر بين بطانة الرحم الطبيعية وسرطان بطانة الرحم (EC) بناءً على PCDHGB731.تعد UCOMs فريدة من نوعها بالنسبة للآفات الخبيثة في قواعد البيانات والعينات السريرية.من وجهة نظر المريض، تعمل UCOMs الفريدة على تقليل عتبة فهم المؤشرات المعقدة لمختلف المؤشرات الحيوية غير المستقرة ذات الأداء الضعيف والقلق المقابل أثناء عملية التقييم.من وجهة نظر الطبيب السريري، تميز UCOMs الفريدة بين الأورام الخبيثة والآفات الحميدة، مما يساعد في فرز المرضى ويقلل من الإجراءات الطبية غير الضرورية والإفراط في العلاج.ولذلك، فإن UCOMs الفريدة تقلل من تكرار النظام الطبي، وتخفف من ضائقة النظام، وتوفر المزيد من الموارد الطبية للمحتاجين.
الشكل 1: رسم تخطيطي لسير عمل نظام تحديد المواقع العالمي (GPS) للكشف عن مثيلة الحمض النووي.الخط الرمادي: إدخال تسلسل الحمض النووي؛الخط الأحمر: تمت معالجة الحمض النووي باستخدام بوليميريز الحمض النووي T4، واستبدال السيتوزين بـ 5 ميثيل سيتوزين في الطرف 3 of من الإدخال؛الأزرق C معي: السيتوزين الميثيل؛الأزرق C: السيتوزين غير الميثيل؛الأصفر T: الثيمين25.
كل شيء أو لا شيء
UCOMs موجودة فقط في الخلايا السرطانية ويتم اكتشافها بشكل ثابت في جميع الخلايا السرطانية تقريبًا.تم التحقق من صحة HIST1H4F ليكون مفرط الميثيل في جميع أنواع الأورام تقريبًا ولكن ليس في العينات الطبيعية .وبالمثل، فقد ثبت أيضًا أن PCDHGB7 وSIX6 مفرط الميثيل في جميع عينات الورم ولكن ليس في العينات الطبيعية.تعمل هذه الخاصية الفريدة على تحسين أداء UCOMs بشكل كبير فيما يتعلق بحدود الكشف والحساسية.يمكن تمييز ما يصل إلى 2٪ من الخلايا السرطانية في العينات، مما يجعل UCOMs علامة حيوية أكثر حساسية بكثير من معظم المؤشرات الحيوية الموجودة. كمؤشر حيوي يستخدم للكشف عن سرطان القولون والمستقيم، توجد طفرات KRAS فقط في حوالي 36٪ من حالات سرطان القولون والمستقيم. مما يشير إلى ضعف إمكانات التشخيص .إن انخفاض معدل انتشار طفرات KRAS في سرطان القولون والمستقيم يحد من KRAS بالاشتراك مع المؤشرات الحيوية الأخرى.في الواقع، قد يبدو مزيج من المؤشرات الحيوية واعدًا في البداية، لكنه لا يؤدي دائمًا إلى نتيجة مرضية بينما يُظهر ضجيجًا أكبر بكثير في تحليل الكشف وعادةً ما يتضمن إجراءات تجريبية أكثر تعقيدًا.في المقابل، PCDHGB7 وUCOMs الأخرى موجودة في جميع أنواع السرطان.تكتشف UCOMs المكونات السرطانية في أنواع مختلفة من عينات السرطان بأقصى قدر من الدقة مع القضاء على عمليات التحليل المعقدة لإلغاء الضوضاء.ليس من الصعب اكتشاف السرطان في عينة وفيرة، ولكن من الصعب للغاية اكتشاف السرطان في عينة صغيرة.UCOMs قادرة على اكتشاف كميات صغيرة من السرطان.
الشكل 2: خصائص UCOMs.
الكشف عن السرطان قبل التغيرات المرضية
يمكن اكتشاف UCOMs في مرحلة ما قبل السرطان قبل التغيرات المرضية.كمؤشرات حيوية جينية، تحدث تشوهات UCOM في مرحلة مبكرة من تشوهات النمط الظاهري ويمكن اكتشافها خلال تكوين الأورام والتقدم والورم النقيلي.تعمل حساسية UCOM بمرور الوقت على تعزيز أداء UCOM في اكتشاف السرطان في المراحل المبكرة والآفات السابقة للسرطان.قد يكون الكشف المبكر عن السرطان بناءً على الخزعات وعلم الخلايا أمرًا صعبًا حتى بالنسبة لعلماء الأمراض الأكثر خبرة.تم الإبلاغ عن أن خزعة واحدة تم الحصول عليها عن طريق التنظير المهبلي كانت إيجابية في 60.6% من عينات HSIL+.هناك حاجة إلى خزعات إضافية للآفات المتعددة لزيادة الحساسية.في المقابل، UCOM، PCDHGB7، لديه حساسية 82٪ لعينات HSIL +، متجاوزة حساسية الخزعات ومعظم المؤشرات الحيوية.تتمتع علامة المثيلة، FAM19A4، بحساسية تبلغ 69% لـ CIN2+، والتي تشبه علم الخلايا، ولكنها لا تستطيع التمييز بين CIN1 والعينات الطبيعية.لقد ثبت أن UCOMs هي علامة حيوية للكشف المبكر أكثر حساسية.بالمقارنة مع علماء الأمراض المعتمدين على الخبرة، تتمتع UCOMs بحساسية فائقة للكشف عن السرطانات في مراحلها المبكرة، مما يساهم بدوره في تحسين تشخيص السرطان والبقاء على قيد الحياة.بالإضافة إلى ذلك، توفر UCOMs منصة كشف يمكن الوصول إليها للمناطق التي تفتقر إلى علماء الأمراض ذوي الخبرة وتحسن كفاءة الكشف بشكل كبير.من خلال إجراءات أخذ العينات والكشف الموحدة، يؤدي اكتشاف UCOM إلى نتائج مستقرة وسهلة التفسير تناسب بشكل أفضل بروتوكول الفحص الذي يتطلب عددًا أقل من الموظفين المحترفين والموارد الطبية.
من السهل اكتشافها
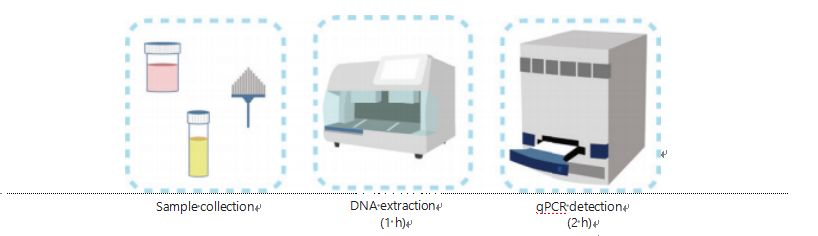
الطرق الحالية للكشف عن مثيلة الحمض النووي معقدة وتستغرق وقتًا طويلاً.تتطلب معظم الطرق تحويل بيكبريتيت، مما يسبب خسارة في جودة العينة وربما يؤدي إلى نتائج غير مستقرة وغير دقيقة.من المحتمل أن يؤدي ضعف التكاثر الناتج عن علاج ثنائي الكبريتيت إلى إرباك الأطباء والمرضى ويتداخل بشكل أكبر مع استراتيجيات المتابعة و/أو العلاج.ولذلك، قمنا بتعديل طريقة الكشف عن UCOM لتجنب معالجة بيكبريتيت إشكالية للعينات، واستيعاب متطلبات التطبيق السريري، وتعزيز إمكانية الوصول.قمنا بتطوير طريقة جديدة باستخدام إنزيمات التقييد الحساسة للميثيل مقترنة مع PCR الكمي الفلورسنت في الوقت الحقيقي (Me-qPCR) لتحديد حالة مثيلة UCOMs خلال 3 ساعات باستخدام إجراءات التعامل السهل (الشكل 3).يمكن أن يستوعب Me-qPCR أنواعًا متعددة من العينات، مثل الجمع السريري لسوائل الجسم وعينات البول المجمعة ذاتيًا.يمكن معالجة العينات السريرية التي تم جمعها، وتخزينها، والشروع في الكشف عنها بسهولة باستخدام استخراج الحمض النووي القياسي والآلي.يمكن بعد ذلك تطبيق الحمض النووي المستخرج مباشرة على منصة Me-qPCR للحصول على نتائج تفاعلية وقياس كمي للإخراج.بعد تحليل النتائج البسيطة باستخدام نماذج تشخيصية تم تركيبها والتحقق من صحتها لأنواع محددة من السرطان، يتم تفسير التحديد النهائي لنتائج اكتشاف UCOM وتقديمه كقيمة شبه كمية.تتفوق منصة Me-qPCR على تسلسل بيكبريتيت التقليدي في الكشف عن UCOM مع توفير 3 ساعات من تحويل بيكبريتيت، وفقًا لبروتوكول مجموعة EZ DNA Methylation-Gold.تجعل منصة الكشف عن المثيلة المبتكرة اكتشاف UCOM أكثر استقرارًا وأكثر دقة ويمكن الوصول إليه بشكل أكبر.
الشكل 3: عملية الكشف عن UCOMs.تتضمن أنواع العينات عينات احترافية من BALF و/أو فرشاة Pap و/أو البول المجمع ذاتيًا.يمكن استيعاب عملية استخراج الحمض النووي لمستخرج تلقائي، يمكن الكشف عن المنتج مباشرة بواسطة qPCR.
تطبيق UCOMs
سرطان الرئة
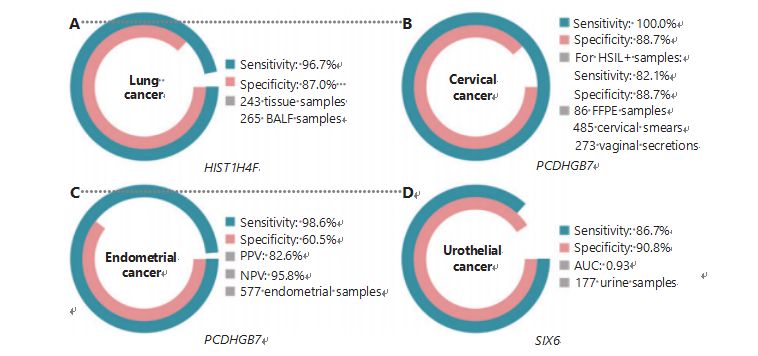
يعد سرطان الرئة ثاني أكثر أنواع السرطان تشخيصًا والأكثر فتكًا في جميع أنحاء العالم، حيث يمثل 11.4% من الحالات الجديدة و18.0% من الوفيات الجديدة.من بين جميع التشخيصات، 85% منها عبارة عن سرطان الرئة ذو الخلايا غير الصغيرة (NSCLC) و15% عبارة عن سرطان الرئة ذو الخلايا الصغيرة (SCLC)، الذي يحتوي على مستوى أعلى من الأورام الخبيثة.يعد التصوير المقطعي المحوسب بجرعة منخفضة (LDCT) طريقة الفحص الموصى بها حاليًا لسرطان الرئة وقد ثبت أنه يحسن الكشف المبكر ويقلل الوفيات 6؛ومع ذلك، نظرًا لانخفاض الخصوصية وضعف إمكانية الوصول، فإن LDCT لم يكن بعد بمثابة طريقة فحص مرضية، كما هو الحال مع علامات السرطان الشائعة الأخرى، مثل CEA39.التكاليف واحتمالات التشخيص المفقود والتشخيص الخاطئ لاستراتيجية فحص LDCT تعيق تقدم الترويج لفحص سرطان الرئة .يتمتع HIST1H4F، UCOM، بإمكانات هائلة كمؤشر حيوي للكشف المبكر في عينات السائل القصبي السنخي (BALF) .يتم فرط ميثيل HIST1H4F في سرطان الرئة الغدي وسرطان الخلايا الحرشفية الرئوية، مع خصوصية الكشف بنسبة 96.7٪ وحساسية 87.0٪ (الشكل 4A)، وأداء استثنائي لسرطانات المرحلة الأولى.يتمتع HIST1H4F بخصوصية 96.5% وحساسية 85.4% لـ NSCLC، و96.5% و95.7% على التوالي لـSCLC27.بالإضافة إلى ذلك، أثبتت عينات من ثمانية أنواع أخرى من السرطان، بما في ذلك سرطان البنكرياس وسرطان القولون والمستقيم، أن HIST1H4F مفرط الميثيل في جميع الأنواع الثمانية.
سرطان عنق الرحم
كان سرطان عنق الرحم رابع أكثر أنواع السرطان التي يتم تشخيصها والسبب الرئيسي الرابع لوفيات السرطان لدى النساء في عام 2020، وهو ما يمثل 3.1% من الحالات الجديدة و3.4% من الوفيات المرتبطة بالسرطان على مستوى العالم.ومن أجل القضاء على سرطان عنق الرحم بحلول عام 2030، كما اقترحت منظمة الصحة العالمية، فإن الكشف المبكر عن سرطان عنق الرحم أمر ضروري.إذا تم اكتشافه في مرحلة مبكرة، فإن معدل البقاء على قيد الحياة لمدة 5 سنوات يصل إلى 92٪ مع سرطان عنق الرحم الغازي.تقترح إرشادات جمعية السرطان الأمريكية (ACS) اختبارات علم خلايا عنق الرحم، أو اختبارات فيروس الورم الحليمي البشري الأولية، أو اختبارات الفحص.علم خلايا عنق الرحم هو إجراء غزوي ويمكنه اكتشاف 63.5٪ فقط من حالات CIN2 + .
في المقابل، كان أداء PCDHGB7 أفضل بكثير باستخدام مسحات عنق الرحم والإفرازات المهبلية، ويمكنه التمييز بكفاءة بين HSIL وLSIL في مرحلة مبكرة جدًا.PCDHGB7 وحده لديه حساسية 100.0% ونوعية 88.7% لسرطان عنق الرحم (الشكل 4ب)، وحساسية 82.1% ونوعية 88.7% لعينات HSIL+30.يتمتع PCDHGB7 أيضًا بحساسية 90.9% ونوعية 90.4% في عينات الإفرازات المهبلية لسرطان عنق الرحم، والتي يكون جمعها أسهل بكثير.عند دمجه مع اختبار فيروس الورم الحليمي البشري (HR) عالي الخطورة أو اختبار علم الخلايا Thinprep (TCT)، يتمتع PCDHGB7 بحساسية متزايدة بنسبة 95.7% ونوعية بنسبة 96.2%، وهو ما يتجاوز بشكل ملحوظ اختبار hrHPV (20.3%)، وTCT (51.2%). )، والاثنين مجتمعين (57.8٪) لسرطان عنق الرحم.لقد ثبت أيضًا أن PCDHGB7 مفرط الميثيل في 17 نوعًا من السرطان من قاعدة بيانات TCGA، مما يشير إلى ملاءمته لعائلة UCOM.
الشكل 4: تم التحقق من صحة UCOMs في أربعة أنواع من السرطان في الدراسات السريرية واسعة النطاق.A. أداء HIST1H4F، UCOM، في الكشف عن سرطان الرئة في 508 عينة.B. أداء PCDHGB7، UCOM، في الكشف عن سرطان عنق الرحم من 844 عينة.ج. أداء PCDHGB7، UCOM، في الكشف عن سرطان بطانة الرحم في 577 عينة من فرشاة عنق الرحم وتاو.د. أداء SIX6، UCOM، في الكشف عن سرطان الظهارة البولية لـ 177 عينة.
EC
يعد سرطان القولون والمستقيم أحد أكثر أنواع سرطانات الجهاز التناسلي الأنثوي شيوعًا في جميع أنحاء العالم، حيث يقدر عدد الحالات الجديدة بنحو 4.2 مليون حالة و1٪ من الوفيات المرتبطة بالسرطان سنويًا.مع التشخيص الناجح في مرحلة مبكرة، تكون حالات الطوارئ قابلة للشفاء ويبلغ معدل البقاء على قيد الحياة لمدة 5 سنوات 95٪ للمرحلة الأولى من السرطان.المرضى الذين تظهر عليهم أعراض، مثل نزيف الرحم غير الطبيعي، يتلقون تقييمًا سريريًا دوريًا ويخضعون لإجراءات خزعة مؤلمة، على الرغم من أن 5٪ إلى 10٪ فقط يصابون في نهاية المطاف بـ EC43.لا يمكن الاعتماد على الموجات فوق الصوتية عبر المهبل، باعتبارها طريقة الكشف الشائعة، إلى حد كبير بسبب عدم قدرتها على التمييز بين التغيرات الحميدة والخبيثة في بطانة الرحم والمعدل الإيجابي الكاذب المرتفع.
تم إجراء مقارنة موازية للمصل CA-125، وهو علامة حيوية EC تم تنفيذها على نطاق واسع، وPCDHGB7.كانت حساسية المصل CA-125 تبلغ 24.8%، مما يشير إلى أن CA-125 يعد علامة غير كافية للمفوضية الأوروبية على الرغم من خصوصيته البالغة 92.3%.أدى الكشف عن PCDHGB7 باستخدام عينات فرشاة Pap إلى حساسية قدرها 80.65% ونوعية قدرها 82.81% لمراحل ECatall، بينما كانت حساسية فرشاة Tao تبلغ 61.29% ونوعية قدرها 95.31%.أنتج نموذج التشخيص PCDHGB7، المستند إلى Me-qPCR، حساسية قدرها 98.61%، ونوعية 60.5%، ودقة إجمالية قدرها 85.5%، باستخدام عينات فرشاة Pap وTao (الشكل 4C)31.
سرطان الظهارة البولية
كان سرطان الظهارة البولية، الذي يتكون من سرطانات المثانة والحوض الكلوي والحالب، هو سابع أكثر أنواع السرطان تشخيصًا في عام 2020 في جميع أنحاء العالم، مما تسبب في 5.2% من الحالات الجديدة و3.9% من الوفيات.كانت سرطانات الظهارة البولية، التي يشكل سرطان المثانة أكثر من 50% منها، رابع أكثر أنواع السرطان تشخيصًا في الولايات المتحدة في عام 2022، وهو ما يمثل 11.6% من الحالات التي تم تشخيصها حديثًا.يتم تصنيف ما يقرب من 75٪ من سرطانات المثانة على أنها سرطان المثانة غير الغازية يقتصر على الغشاء المخاطي أو تحت المخاطية.تعتبر خزعة تنظير المثانة هي المعيار الذهبي لتشخيص سرطان الظهارة البولية الذي يتم تنفيذه عن طريق التهجين الموضعي (FISH) واختبارات علم الخلايا.يتمتع FISH وعلم الخلايا بأداء تشخيصي ضعيف، كما أن تنظير المثانة تدخلي وينطوي على خطر فقدان الآفات الدقيقة، وسوء تفسير الآفات، واحتمال التسبب في انتشار السرطان أو انتكاسه .وقد تبين أيضًا أن UCOM، PCDHGB7، الذي تم التحقق من صحته مسبقًا، يعاني من فرط الميثيل في سرطان الظهارة البولية، مع مساحة تحت المنحنى 0.86، مما يشير إلى قدرة تشخيصية محتملة.لمزيد من التحقق من صحة المزيد من UCOMs واستيعاب المزيد من أنواع العينات بشكل أفضل، تم فحص SIX6، وهو UCOM الجديد، وأظهر إمكانات تشخيصية ممتازة في الكشف المبكر عن سرطان الظهارة البولية باستخدام عينات البول على منصة Me-qPCR.أظهر اكتشاف SIX6 باستخدام عينات البول حساسية تنافسية بنسبة 86.7% وخصوصية قدرها 90.8% (الشكل 4D)، في حين أنه غير جراحي وسهل الحصول عليه.إن إمكانات SIX6 في مراقبة ورم خبيث وتقييم فعالية العلاج قيد التحقيق حاليًا.
المستقبل والتحديات
تتمتع UCOMs بأداء قوي في إمكانات تشخيص السرطانات المتعددة، ولكن لا يزال هناك الكثير من العمل الذي يتعين القيام به.لقد قمنا بتوسيع قائمة UCOMs وقمنا بالتحقق من صحة UCOMs بشكل نشط في المزيد من أنواع السرطان، بما في ذلك تلك التي يصعب اكتشافها تقليديًا.لقد أكدت نتائج التحقق من صحة قواعد بيانات TCGA بشكل أكبر تطبيق UCOMs في المزيد من أنواع السرطان والمزيد من المواقف.في التحقيق الأولي، تبين أن UCOMs لديها إمكانات تشخيصية قوية لسرطان القنوات الصفراوية والأورام الغدية البنكرياسية، والتي يكاد يكون من المستحيل تشخيصها في مرحلة مبكرة باستخدام طرق الفحص الحالية.يمكن الاستفادة من القدرة على اكتشاف السرطانات النادرة باستخدام UCOMs مع الحمض النووي للورم (ctDNA) من خلال منصة خزعة سائلة محسنة.أسفرت دراسة شملت لوحة الكشف عن السرطان الشامل المستندة إلى الحمض النووي في البلازما عن حساسية بنسبة 57.9%.وعلى الرغم من الخصوصية العالية، فإن الأداء العام يكشف أنه لا يزال هناك مجال للتحسين.
وقد دعمت الخصائص الفريدة لـ UCOMs أيضًا التحقيق في إمكانات UCOM في تقييم فعالية العلاج ومراقبة التكرار.وفقًا لمعايير تقييم الاستجابة للأورام الصلبة (RECIST)، فإن التصوير الطبي هو المنهجية الموصى بها لمراقبة تكرار المرض وتقييم فعالية العلاج، في حين يتم استخدام علامات الورم وحدها للتقييم.ومع ذلك، في الواقع، تتأثر أساليب التصوير بشكل كبير بالتكرار والتوقيت، وبالتالي تعرض المرضى لمخاطر وتكاليف أعلى.تم التحقق من صحة SIX6 ليكون بمثابة مؤشر لانتشار سرطان الثدي .تتيح مراقبة ctDNA المستندة إلى الخزعة السائلة المراقبة في الوقت الفعلي على الحد الأدنى من الأمراض المتبقية قبل أشهر من الكشف الإشعاعي، مما يؤدي بشكل مثالي إلى تأخير ومنع تطور السرطان المرتبط بالانتكاس.تشير النتائج الأولية إلى أن UCOMs تعكس مستوى فرط الميثيل السرطاني في الوقت الحقيقي مباشرة بعد الجراحة والعلاج .إن الحساسية العالية التي أبدتها UCOMs وقابلية التطبيق في أنواع متعددة من العينات غير التدخلية تسمح لـ UCOMs بالعمل كمؤشر حيوي دقيق لمراقبة التكرار مع الحفاظ على الامتثال العالي للمريض.
وفي الوقت نفسه، تعد إمكانية وصول الجمهور إلى الاختبار قضية رئيسية أخرى تتطلب جهدًا إضافيًا.في حين تم اعتماد التعاون في الكشف عن UCOM في المزيد من المستشفيات على أمل إفادة المزيد من المرضى، فقد تم إجراء عمليات الكشف والفحوصات المجانية بنشاط في المناطق الريفية في الصين.تتطلب UCOMs إمكانية الوصول المحسنة للتأهل كأداة فحص مجدية، خاصة بالنسبة للمناطق المتخلفة.
في حين أن نتائج تطبيق UCOM في الكشف المبكر واعدة، إلا أن هناك العديد من الأمور المجهولة حول UCOM.مع الاستكشاف النشط، هناك ما يبرر إجراء بحث إضافي حول سبب وجود UCOMs عالميًا في السرطانات.تستحق آليات التنظيم اللاجيني الكامنة وراء UCOMs مزيدًا من البحث، مما قد يبرر اتجاهًا جديدًا لعلاجات السرطان.بالعودة إلى التفاعل بين تجانس الورم وعدم تجانسه، نحن مهتمون بمعرفة السبب وراء كون UCOMs استثناءً لغالبية المؤشرات الحيوية للسرطان التي ترتبط ارتباطًا وثيقًا بأنواع معينة من السرطان.لم يتم تحديد دور انحرافات مثيلة الحمض النووي التي تم تحديدها بواسطة UCOM في تكوين الأورام وتطور الورم والورم الخبيث في عملية فقدان هوية الخلية واستعادتها ويستلزم إجراء فحص شامل.يكمن اهتمام رئيسي آخر في نطاق دمج سمة التجانس لـ UCOMs مع علامات الأنسجة الفريدة على أمل الاقتراب من الكشف الدقيق عن آثار السرطان وتحديد أصول أنسجة الورم بطريقة عكسية.يمكن أن تكون UCOMs أداة مثالية للوقاية من السرطان، واكتشاف السرطان، وربما الدفاع عن السرطان والقضاء عليه.
منح الدعم
تم دعم هذا العمل من قبل البرنامج الوطني للبحث والتطوير الرئيسي في الصين (المنحة رقم 2022BEG01003)، والمؤسسة الوطنية للعلوم الطبيعية في الصين (المنحة رقم 32270645 و32000505)، ومنحة من لجنة الصحة بمقاطعة هيلونغجيانغ (المنحة رقم 2020-111) ومنحة من معهد هيزي للعلوم والتكنولوجيا (المنحة رقم 2021KJPT07).
بيان تضارب المصالح
Wei Li هو مدير البحث والتطوير في شركة Shanghai Epiprobe Biotechnology Co., Ltd. ويعمل Wenqiang Yu في المجلس الاستشاري العلمي لشركة Epiprobe.وقد وافق W. Yu وEpiprobe على براءات الاختراع المعلقة المتعلقة بهذا العمل.جميع المؤلفين الآخرين يعلنون عدم وجود مصالح متنافسة.
الكاتب الاشتراكات
تصور وتصميم المشروع: Chengchen Qian وWenqiang Yu.
كتب الورقة: تشنغشن تشيان.
صنع الرسوم التوضيحية: تشنغشن تشيان.
قام بمراجعة المخطوطة وتحريرها: شياو لونغ زو، ووي لي، ويينشان لي، ووينكيانغ يو.
مراجع
1. سونغ إتش، فيرلي جي، سيجل آر إل، لافيرسان إم، سورجوماتارام آي، جمال إيه، وآخرون.إحصاءات السرطان العالمية 2020: تقديرات GLOBOCAN لـ
حالات الإصابة والوفيات في جميع أنحاء العالم لـ 36 حالة سرطان في 185 دولة.CA السرطان J كلين.2021؛71: 209-49.
2. شيا سي، دونغ إكس، لي إتش، كاو إم، صن دي، هي إس، وآخرون.إحصاءات السرطان في الصين والولايات المتحدة، 2022: الملامح والاتجاهات والمحددات.تشين ميدج (انجليزي).2022؛135: 584-90.
3. سيجل آر إل، ميلر كيه دي، واجل إن إس، جمالا.إحصائيات السرطان، 2023. CA Cancer J Clin.2023؛73: 17-48.
4. كروسبي د، بهاتياس، بريندل كم، كوسينز إل إم، دايف سي، إمبرتون إم، وآخرون.الكشف المبكر عن السرطان.علوم.2022؛375: eaay9040.
5. لاداباوم يو، دومينيتز جيه إيه، كاهيك، شوين ري.استراتيجيات ل
فحص سرطان القولون والمستقيم.أمراض الجهاز الهضمي.2020;158: 418-32.
6. تانو لوت، تانر إن تي، جولد إم كيه، سيلفستري جي إيه.فحص سرطان الرئة.Am J Respir Crit Care Med.2015؛191: 19-33.
7. بوفارد ف، وينتزينسين إن، ماكي أ، بيركوف جيه، بروذرتون جيه، جيورجي روسي بي، وآخرون.منظور IARC بشأن فحص سرطان عنق الرحم.N EnglJ ميد.2021؛385: 1908-18.
8. شيويه بي، إن جي إم تي إيه، كياوي.تحديات التنظير المهبلي لفحص سرطان عنق الرحم في البلدان المنخفضة والمتوسطة الدخل والحلول بواسطة الذكاء الاصطناعي.بي إم سي ميد.2020;18: 169.
9. جونسون بي، تشو كيو، داو دي واي، لو واي إم دي.تعميم المؤشرات الحيوية في تشخيص وإدارة سرطان الخلايا الكبدية.نات القس غاسترونتيرول هيباتول.2022؛19: 670-81.
10. Van PoppelH، Albreht T، Basu P، HogenhoutR، CollenS، Roobol M. Serum الكشف المبكر عن سرطان البروستاتا في أوروبا والعالم: الماضي والحاضر والمستقبل.نات القس أورول.2022؛19:
562-72.
11. هوليوكي، أوسوليفان بي، بولوك آر، بيست تي، واتانابي جيه، كاجيتاي،
وآخرون.تطوير اختبار البول RNA المتعدد للكشف والتقسيم الطبقي لسرطان الخلايا الانتقالية في المثانة.الدقة السريرية للسرطان.2008;14: 742-9.
12. Feinberg AP, Vogelstein B. Hypomethylation يميز جينات بعض أنواع السرطان البشرية عن نظيراتها الطبيعية.طبيعة.1983;301: 89-92.
13. Ng JM، Yu J. فرط الميثيل المروج للجينات الكابتة للورم كمؤشرات حيوية محتملة في سرطان القولون والمستقيم.IntJ مول العلوم.2015؛16: 2472-96.
14. Esteller M. علم اللاجينوم السرطاني: ميثيلومات الحمض النووي وخرائط تعديل الهيستون.نات القس جينيت.2007;8: 286-98.
15. نيشياما أ، ناكانيشي م. التنقل في مشهد مثيلة الحمض النووي للسرطان.اتجاهات جينيه.2021؛37: 1012-27.
16. شيه دبليو، شولتز إم دي، ليستر آر، هو زي، راجاجوبال إن، راي بي، وآخرون.التحليل اللاجينومي للتمايز متعدد السلالات للخلايا الجذعية الجنينية البشرية.خلية.2013;153: 1134-48.
17. لي واي، تشنغ إتش، وانغ كيو، تشو سي، ويل، ليو إكس، وآخرون.تكشف التحليلات على مستوى الجينوم عن دور Polycomb في تعزيز نقص الميثيل في أودية مثيلة الحمض النووي.الجينوم بيول.2018;19: 18.
18. كوتش أ، جوستين إس سي، فينج زد، دي رويجتر تي سي، درامت إم إكس، ميلوتيف،
وآخرون.تحليل مثيلة الحمض النووي في السرطان: إعادة النظر في الموقع.نات القس كلين أونكول.2018;15: 459-66.
19. كلاينيا، ريتشاردز د، كوهن أ، تومالام، لافام آر، كوسجروف د، وآخرون.التحقق السريري من اختبار الكشف المبكر عن السرطان المتعدد القائم على المثيلة باستخدام مجموعة التحقق المستقلة.آن أونكول.2021؛32: 1167-77.
20. هاناهان د، واينبرغ ر.أ.العلامات المميزة للسرطان.خلية.2000؛100: 57-70.
21. هاناهان د. السمات المميزة للسرطان: أبعاد جديدة.اكتشاف السرطان.2022؛12: 31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. علم الأورام الدقيق: من وكيف وماذا ومتى ومتى لا؟أنا Soc كلين أونكول كتاب التعليم.2017: 160-9.
23. ليو إتش، منغ إكس، وانغ جيه. المثيلة الكمية في الوقت الحقيقي
الكشف عن الجين PAX1 في فحص سرطان عنق الرحم.IntJ Gynecol السرطان.2020;30: 1488-92.
24. إمبريال تي إف، رانسوهوف دي إف، إيتزكويتز إس إتش، ليفين تي آر، لافين بي، ليدغارد جي بي، وآخرون.اختبار الحمض النووي متعدد الأهداف لفحص سرطان القولون والمستقيم.N EnglJ ميد.2014;370: 1287-97.
25. لي جي، لي واي، لي دبليو، لوه إتش، شي واي، دونغ إس، وآخرون.تحديد المواقع الدليل
يحدد التسلسل أنماط مثيلة الحمض النووي الشاذة التي تغير هوية الخلية وشبكات مراقبة المناعة للورم.الجينوم
الدقة.2019;29: 270-80.
26. جاو كيو، لينيب، لي بي إس، وانغ جي كيو، دونغ إل كيو، شين بي، وآخرون.اكتشاف غير متداخل للسرطان المتعدد عن طريق تعميم تسلسل مثيلة الحمض النووي الخالي من الخلايا (THUNDER): التطوير ودراسات التحقق المستقلة.آن أونكول.2023؛34: 486-95.
27. دونغ إس، لي دبليو، وانغ إل، هو جي، سونغ واي، تشانغ بي، وآخرون.الجينات المرتبطة بالهيستون مفرطة الميثيل في سرطان الرئة ومفرطة الميثيل
يمكن أن يكون HIST1H4F بمثابة علامة حيوية للسرطان.الدقة السرطان.2019;79: 6101-12.
28. هيجنسديجكيا، ويفير إم، أوفينينا، هوغوسون جيه، سياتو إس، نيلين في، وآخرون.تأثيرات جودة الحياة لفحص مستضد البروستاتا الخاص.N EnglJ ميد.2012;367: 595-605.
29. LuzakA، Schnell-Inderst P، Bühn S، Mayer-Zitarosa A، Siebert U. الفعالية السريرية لاختبارات العلامات الحيوية لفحص السرطان المقدمة كخدمة صحية ذاتية الدفع: مراجعة منهجية.يورو جي للصحة العامة.2016;26: 498-505.
30. دونغ إس، لو كيو، شو بي، تشن إل، دوان إكس، ماو زي، وآخرون.
Hypermethylated PCDHGB7 كعلامة عالمية للسرطان فقط وتطبيقه في الفحص المبكر لسرطان عنق الرحم.كلين ترانس ميد.2021؛11:هـ457.
31. يوان جي، ماو زي، لو كيو، شو بي، وانغ سي، شو إكس، وآخرون.Hypermethylated PCDHGB7 كمؤشر حيوي للكشف المبكر عن سرطان بطانة الرحم في عينات فرشاة بطانة الرحم وكشط عنق الرحم.الجبهة مول Biosci.2022؛8 : 774215.
32. دونغ إس، يانغ زي، شو بي، تشنغ دبليو، تشانغ بي، فو إف، وآخرون.متبادل
تعديل جيني حصري على SIX6 مع فرط الميثيل للمرحلة السابقة للتسرطن وتتبع ظهور ورم خبيث.هدف نقل الإشارة هناك.2022؛7: 208.
33. طفرة Huang L، Guo Z، Wang F، Fu L. KRAS: من غير قابل للتخدير إلى قابل للتخدير في السرطان.هدف نقل الإشارة هناك.2021؛6: 386.
34. بيلينسكي إس إيه، نيكولا كيه جيه، بالميسانووا، ميشيلسر، ساكومانو جي، غابريلسون إي، وآخرون.يعد المثيلة الشاذة لـ p16 (INK4a) حدثًا مبكرًا في سرطان الرئة وعلامة حيوية محتملة للتشخيص المبكر.Proc Natl Acad Sci U SA.1998;95: 11891-6.
35. روبرتسون د.ك.مثيلة الحمض النووي والأمراض التي تصيب الإنسان.نات القس جينيت.2005;6: 597-610.
36. وينتزينسين إن، ووكر جيه إل، جولد إم إيه، سميث كي إم، زونا آر إي،
ماثيوز سي، وآخرون.الخزعات المتعددة والكشف عن سلائف سرطان عنق الرحم في التنظير المهبلي.J كلين أونكول.2015؛33: 83-9.
37. دي ستروبير إل إم، ميجر سي جيه، بيركوف جيه، هيسيلينك إيه تي، سنايدرز
بيجاي، ستينبيرجين آر دي، وآخرون.تحليل الميثيل من FAM19A4
الجين الموجود في خدوش عنق الرحم فعال للغاية في اكتشاف عنق الرحم
السرطانات وآفات CIN2/3 المتقدمة.السرطان السابق الدقة (فيلا).2014;7: 1251-7.
38. تاي أأ، سولومون بي جيه، سيكويست إل في، جاينور جي إف، هيست آر إس.سرطان الرئة.لانسيت.2021؛398: 535-54.
39. جرونيت إم، سورنسن جي بي.المستضد السرطاني المضغي (CEA) كعلامة للورم في سرطان الرئة.سرطان الرئة.2012;76: 138-43.
40. وود دي، كازروني إي إيه، بوم إس إل، إيبينجا، إيتينجير دي إس، هو إل، وآخرون.فحص سرطان الرئة، الإصدار 3.2018، إرشادات الممارسة السريرية لـ NCCN في علم الأورام.J Natl Compr Canc Netw.2018;16: 412-41.
41. جمعية السرطان الأمريكية.حقائق وأرقام عن مرض السرطان.أتلانتا، جورجيا، الولايات المتحدة الأمريكية: جمعية السرطان الأمريكية؛2023 [تم التحديث في 1 مارس 2023؛استشهد 2023 22 أغسطس].
42. فونثاميث، وولف أيه إم دي، تشيرش تي آر، إتزيوني آر، فلاورز سي آر،
هيرزيج أ، وآخرون.فحص سرطان عنق الرحم للأفراد المعرضين لخطر متوسط: تحديث المبادئ التوجيهية لعام 2020 من جمعية السرطان الأمريكية.CA السرطان J كلين.2020;70: 321-46.
43. Clarke MA، Long BJ، Del Mar MorilloA، Arbyn M، Bakkum-Gamez JN، Wentzensen N. رابطة خطر الإصابة بسرطان بطانة الرحم مع نزيف ما بعد انقطاع الطمث لدى النساء: مراجعة منهجية وتحليل تلوي.جاما المتدرب ميد.2018;178: 1210-22.
44. جاكوبس الأول، جينتري مهراجا، بورنيل إم، مانشاندا آر، سينغ إن،
شارما أ، وآخرون.حساسية الفحص بالموجات فوق الصوتية عبر المهبل
لسرطان بطانة الرحم لدى النساء بعد انقطاع الطمث: دراسة الحالات والشواهد ضمن مجموعة UKCTOCS.لانسيت أونكول.2011؛12: 38-48.
45. بابجوكم، برجر إم، كومبيرات إي إم، جونتيرو بي، مصطفى،
بالوج، وآخرون.المبادئ التوجيهية للجمعية الأوروبية لجراحة المسالك البولية بشأن سرطان المثانة غير الغازي للعضلات (TaT1 والسرطان في الموقع) -
تحديث 2019.يورو أورول.2019;76: 639-57.
46. أراغون تشينغ جي بي.التحديات والتقدم في تشخيص وبيولوجيا وعلاج سرطان الظهارة البولية العلوي وسرطان المثانة.أورول أونكول.2017;35: 462-4.
47. ريزفي إس، خانسا، هاليميير سي إل، كيلي آر كيه، جوريس جي جي.
سرطان القنوات الصفراوية – المفاهيم المتطورة والاستراتيجيات العلاجية.نات القس كلين أونكول.2018;15: 95-111.
48. Ye Q، Ling S، Zheng S، Xu X. خزعة سائلة في خلايا الكبد
السرطان: الخلايا السرطانية المنتشرة والحمض النووي للورم.سرطان مول.2019;18: 114.
49. تشانغ واي، ياو واي، شو واي، لي إل، قونغ واي، تشانغ كي، وآخرون.سرطان عموم
اكتشاف الحمض النووي للورم في أكثر من 10000 مريض صيني.نات كومون.2021؛12: 11.
50. أيزنهاور إي إيه، ثيراس بي، بوجارتس جيه، شوارتز إل إتش، سارجنت دي، فورد آر، وآخرون.معايير تقييم الاستجابة الجديدة في الأورام الصلبة: إرشادات RECIST المنقحة (الإصدار 1.1).يورو ي السرطان.2009؛45: 228-47.
51. ليتيير، كوليت إس، دي فريس إي جي، سيمور إل، بوجارتس جيه.RECIST - التعلم من الماضي لبناء المستقبل.نات القس كلين أونكول.
2017;14: 187-92.
52. سيمور إل، بوجارتس جيه، بيروني إيه، فورد آر، شوارتز إل إتش، ماندريكار إس، وآخرون.iRECIST: إرشادات لمعايير الاستجابة لاستخدامها في التجارب
اختبار العلاج المناعي.لانسيت أونكول.2017;18: ه143-52.
53. PantelK، Alix-Panabières C. الخزعة السائلة والحد الأدنى من الأمراض المتبقية – أحدث التطورات والآثار المترتبة على العلاج.نات القس كلين أونكول.2019;16: 409-24.
استشهد بهذا المقال كـ: Qian C, Zou X, Li W, Li Y, Yu W. البؤرة الاستيطانية ضد السرطان: علامات السرطان العالمية فقط.السرطان بيول ميد.2023؛20: 806-815.
دوى: 10.20892/j.issn.2095-3941.2023.0313
وقت النشر: 07 مايو 2024